Notre corps est formé en moyenne de 30 000 milliards de cellules, appartenant à différentes lignées ou types cellulaires, chacune étant spécialisée dans l’exécution d’une fonction spécifique. Les êtres humains sont donc des organismes pluricellulaires, par opposition aux organismes unicellulaires tels que les bactéries ou les levures, qui existent sous forme de cellules uniques. Les cellules sont la plus petite unité de vie et dans notre cas leurs actions coordonnées rendent possible notre existence. Alors que nous pouvons imaginer notre corps comme un objet relativement immobile, avec des os, des organes et des muscles qui gardent leur place, beaucoup de nos cellules sont en fait en mouvement : les leucocytes (également appelés globules blancs) migrent à travers nos tissus pour nous protéger des infections, les cellules de la peau pour refermer les plaies ouvertes, les spermatozoïdes pour réaliser la fécondation, et tout cela sans parler de l’œuvre théâtrale qu’implique le développement d’un tout nouvel organisme à partir d’un embryon primordial. La migration cellulaire est cruciale pour le développement et la stabilité de notre corps, et donc représente en elle-même un domaine de recherche scientifique. C’est ce que nous étudions dans l’équipe d’Olivier Theodoly, au Laboratoire d’Adhésion et Inflammation (LAI), où nous nous intéressons à la migration des leucocytes. Il y a quelques années, une observation surprenante a donné naissance à un nouveau projet : les leucocytes ne se déplacent pas seulement sur des substrats solides, mais parviennent également à nager dans des liquides1. C’est de ce projet que je veux vous parler.
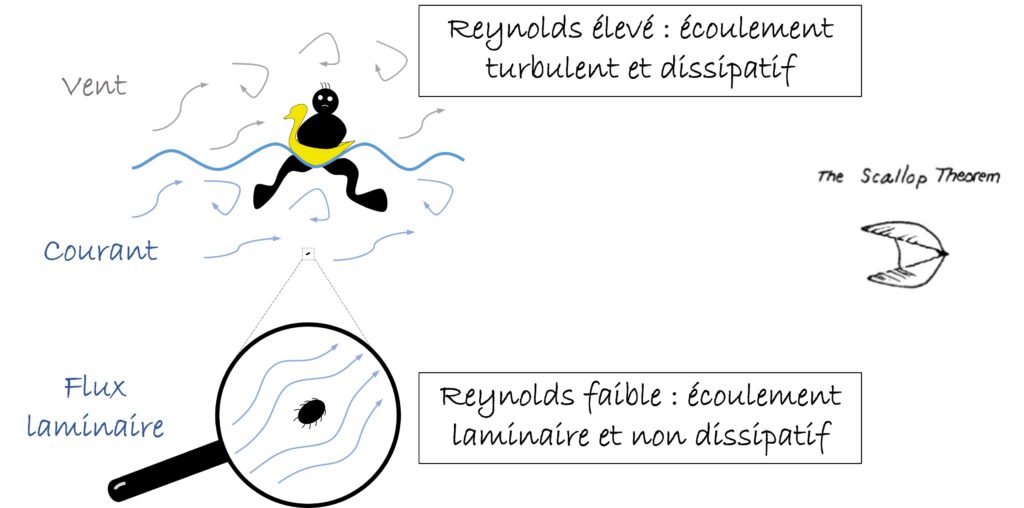
Comment les leucocytes parviennent-ils à nager ? Pour commencer, nous devons faire une remarque cruciale. Nos cellules vivent leur vie à une échelle différente de l’ensemble de notre organisme. De la même façon que les atomes vivent selon les règles de la mécanique quantique, mais que la mécanique classique ou newtonienne est une manière simplifiée de décrire la vie à des échelles plus grandes, nous vivons dans un « macro »-monde turbulent, alors que les cellules vivent dans un « micro »-monde organisé (Figure 1). Nous, les êtres humains, à l’échelle macroscopique, sommes constamment immergés dans un fluide (air ou liquide, peu importe) dont son inertie est plus importante que sa viscosité, créant ainsi du vent, des courants et des turbulences. À cette échelle, le mélange et le transport des fluides sont régis par l’advection. Nos cellules, à l’échelle microscopique, sont également entourées d’un fluide (cette fois-ci uniquement liquide) mais dont la viscosité est plus forte que son inertie. Cela implique que le fluide se déplace sous forme de couches organisées, aussi appelé flux laminaire, et que le mélange et le transport se réalisent plutôt par diffusion. Le rapport entre les forces inertielles et visqueuses est appelé « nombre de Reynolds » et est utilisé pour décrire le système étudié. Si le nombre est élevé, cela signifie que l’inertie et l’advection prédominent, et on parle d’un régime turbulent. Si le nombre est petit, cela signifie que la viscosité et la diffusion prédominent, et on parle d’un régime laminaire. Les cellules vivent dans un régime à faible Reynolds, ce qui a de fortes implications sur les stratégies de migration qu’elles adoptent. Un célèbre et éclairant exemple a été introduit en 1977 par E. M. Purcell, qui l’a appelé « le théorème de la coquille »2. Il se présente comme suit : une coquille Saint-Jacques de taille réelle peut nager en ouvrant lentement sa coquille et en la refermant rapidement, poussant l’eau dans le processus. Il s’agit d’un mouvement réciproque, ce qui signifie que c’est le même mouvement qui est réalisé dans un sens, puis dans l’autre, avec comme seule variation la vitesse. Eh bien, cette stratégie ne fonctionnerait pas pour une imaginaire « micro »-coquille Saint-Jacques dans un régime à faible Reynolds, parce que la distance sur laquelle elle avancerait en fermant sa coquille serait rattrapée en la rouvrant, et elle oscillerait donc toujours dans la même position. La conclusion ? Les cellules ont besoin de nager par mouvements non réciproques et asymétriques.
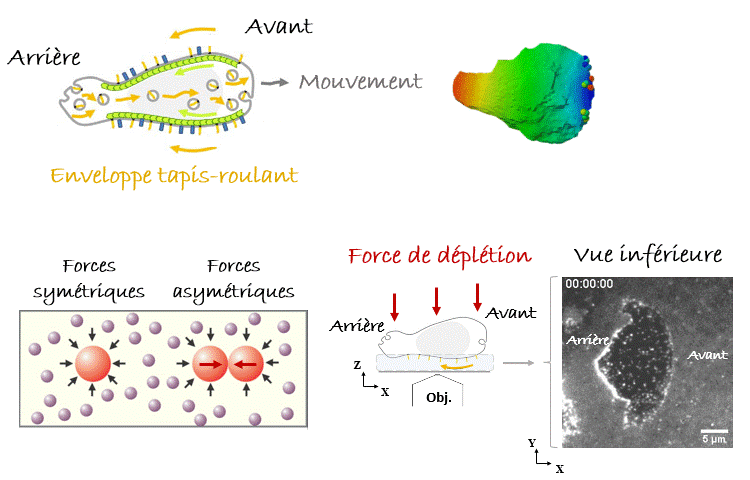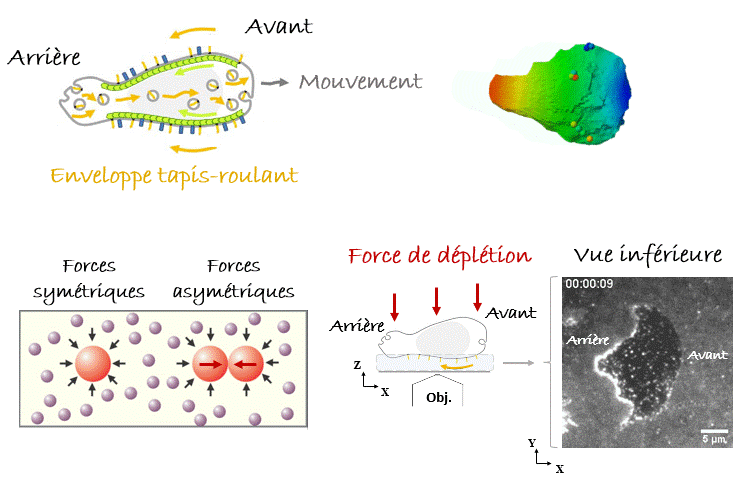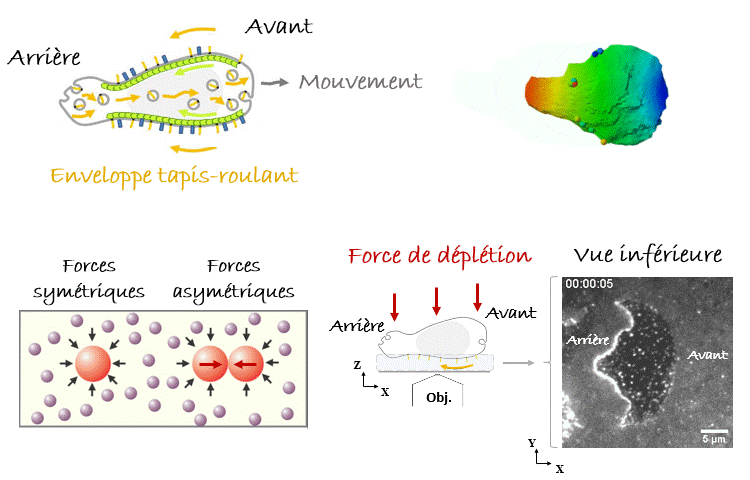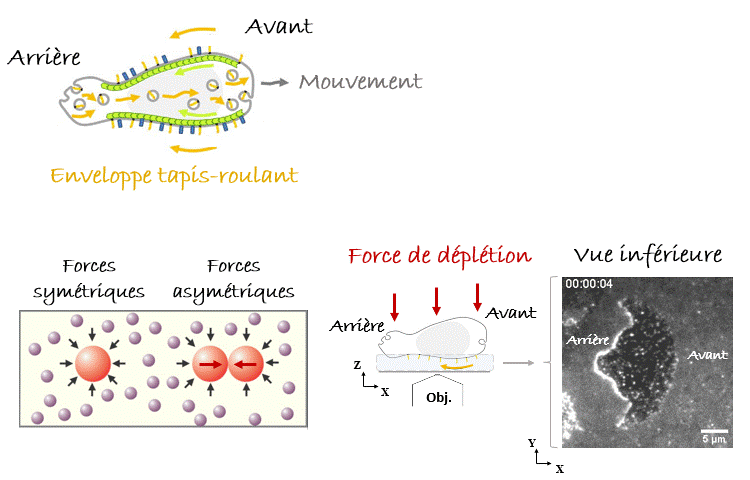
Avec de telles pensées en tête, quand on a vu pour la première fois sous le microscope les leucocytes nager1, notre première hypothèse était qu’ils se propulsaient en poussant le liquide avec les nombreuses protubérances que nous observions, se déplaçant de l’avant vers l’arrière de la cellule (Figure 2). Cependant, lorsque les données ont été introduites dans un modèle théorique, il s’est avéré que la vitesse de nage prédite était de 10 à 1000 fois plus lente que celle observée. La nage par des ondes se déplaçant vers l’arrière est très inefficace ! Au contraire, nous avons réalisé qu’un mécanisme extrêmement efficace consisterait à faire marcher l’enveloppe cellulaire comme un tapis roulant. Les cellules étant dans le régime de Reynolds faible, la viscosité couplerait l’enveloppe cellulaire aux couches de fluide environnantes, qui seraient poussées à s’écouler autour des cellules vers leurs arrières en même temps que leur enveloppe tapis-roulant, tandis que les cellules seraient poussées vers l’avant (Figure 3). Mais comment trouver une preuve expérimentale soutenant cette idée ? Il fallait enregistrer le comportement de l’enveloppe cellulaire sous le microscope, donc avec un fort grossissement, et pour cela il fallait amener les cellules nageuses près de l’objectif et donc de la lame de verre inférieure et transparente, sur laquelle étaient déposés nos échantillons et qui nous permettait de les observer. Nous nous sommes alors servis d’une astuce expérimentale en immergeant les cellules dans une solution très dense et visqueuse composée de longues molécules appelées polymères. Dans ces conditions, les polymères qui se heurtent aux cellules (mouvement brownien en jeu !) créent des forces asymétriques lorsque les cellules se rapprochent, ce qui les regroupe en agrégats. C’est ce qu’on appelle la « force de déplétion ». Heureusement pour nous, le même effet se produit lorsqu’une cellule s’approche des parois du récipient, dans notre cas la lame de verre inférieure de l’échantillon. De cette façon, nous avons pu amener une cellule à nager suffisamment près de l’objectif du microscope pour enregistrer le comportement de son enveloppe cellulaire. Eurêka ! Nous avons pu vérifier que certaines protéines transmembranaires (appelées intégrines) se déplaçaient de l’avant vers l’arrière de la cellule, validant ainsi notre modèle1.

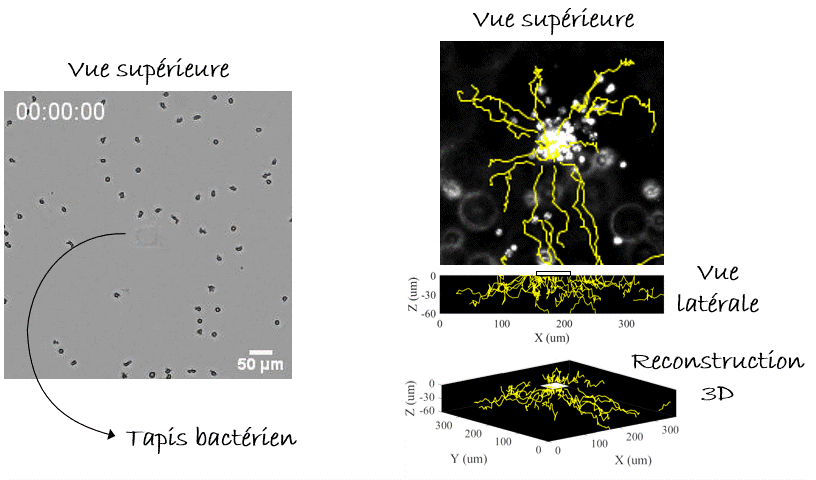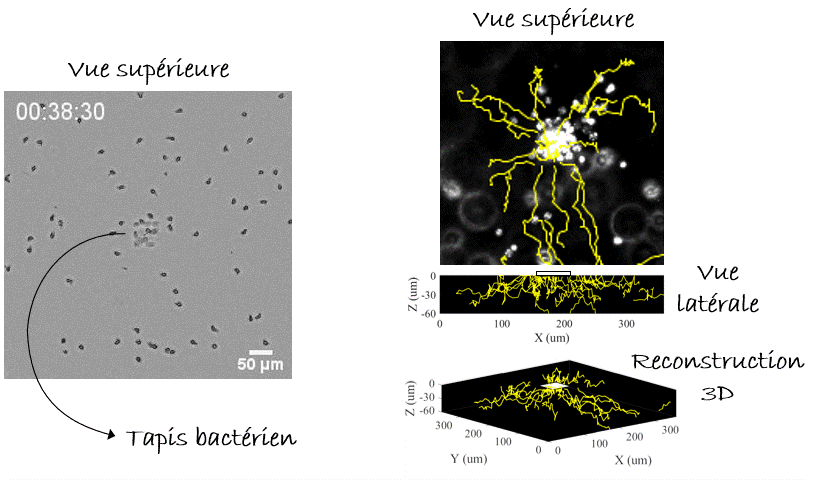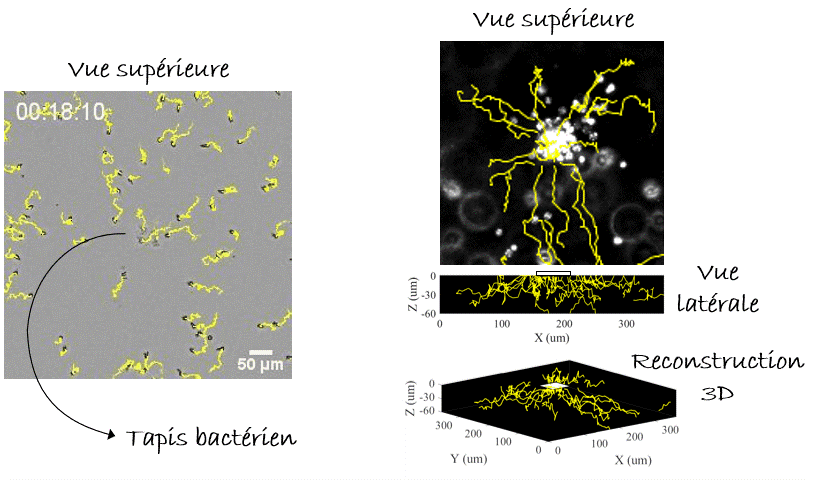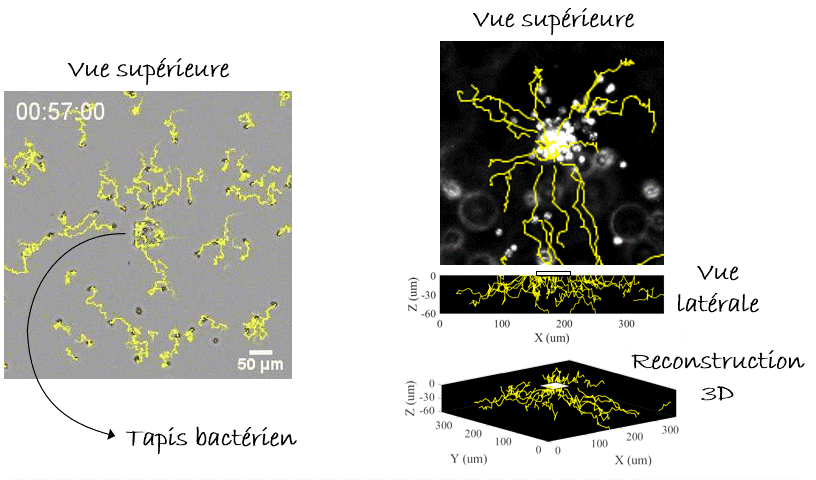
Voilà pour le mécanisme de la natation, mais… Pourquoi nos leucocytes auraient-ils besoin de nager ? Autrement dit, quelle est la pertinence in vivo ? Y a-t-il des liquides dans notre corps ? On pense immédiatement au sang, qui parcourt l’ensemble de notre corps. Mais l’écoulement du sang est tellement fort que la migration n’y est pas possible, de manière que les cellules s’arrondissent et se laissent transporter par cette voie rapide ou «autoroute cellulaire». Alors, reformulons : Y a-t-il des compartiments avec du liquide non coulant dans notre corps, où les cellules pourraient nager ? Eh bien, la réponse est… Oui. Dans le cerveau nous avons le liquide céphalo-rachidien, il y a aussi l’humeur vitrée et aqueuse de l’œil, et pendant la grossesse il y a le liquide amniotique. Dans tous ces compartiments on peut trouver des leucocytes avec des pathogènes (comme des bactéries) ingérés. La nage pourrait-elle être un mécanisme permettant aux leucocytes de chasser les bactéries même dans ces compartiments liquides ? Pour le démontrer fidèlement nous devions capturer des bactéries dans un endroit fixe de l’échantillon, par exemple sur un point de la lame de verre inférieure (eh oui! toujours proche de l’objectif du microscope, vous l’avez compris), et vérifier si les leucocytes étaient attirés vers cet endroit, c’est-à-dire vers les bactéries, par les composants moléculaires produits et diffusant autour d’elles. Mais, à l’époque, il n’y avait pas d’outils pour coller des bactéries vivantes sur une lame de verre. Pour y parvenir, nous avons utilisé une nouvelle astuce. Les anticorps présents dans notre sang sont conçus pour reconnaître et s’accrocher sur les agents pathogènes, notamment les bactéries ou les virus, grâce à un processus appelé « opsonisation ». C’est leur travail : reconnaître les microbes, s’y accrocher (dans certains cas, même les neutraliser ou les tuer) et alerter le système immunitaire. Les anticorps se lient aux agents pathogènes d’un côté, tandis que de l’autre côté ils se lient aux récepteurs présents sur les leucocytes qui déclenchent leur réponse immunitaire. Plus spécifiquement, ce côté des anticorps peut aussi se lier à une protéine particulière appelée « protéine A » qui peut, à son tour, être collée sur une lame de verre avec un outil optique basé sur la lumière UV (LIMAP). Bref, comment avons-nous procédé ? Nous avons dessiné un petit carré de protéine A sur une lame, sur lequel des bactéries opsonisées ont adhéré créant ainsi un beau tapis bactérien, et finalement nous avons libéré des leucocytes par-dessus (Figure 4). Le résultat était spectaculaire, mais le plus intéressant est que nous pouvions voir les cellules converger vers le tapis bactérien, même si l’échantillon était inversé et qu’elles devaient nager vers le haut, contre la gravité ! (Figure 5). La conclusion : les leucocytes peuvent nager de manière dirigée vers leurs cibles (bactériennes)3.
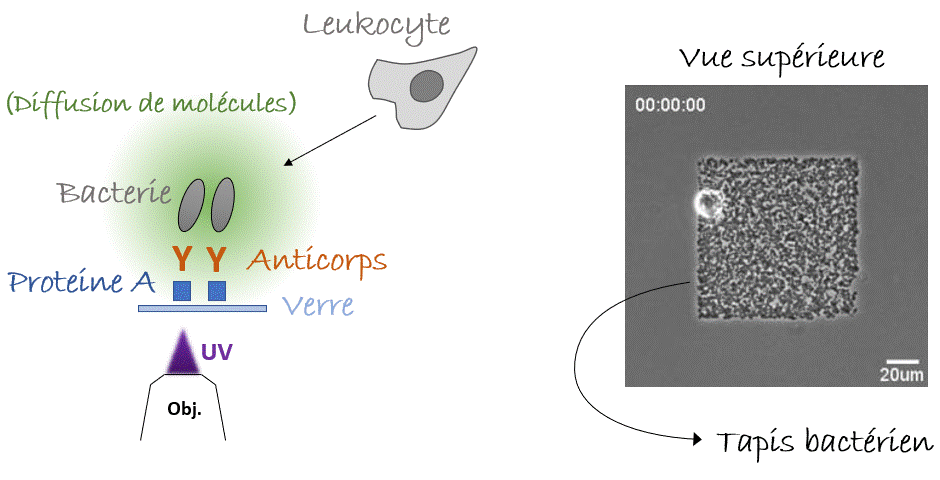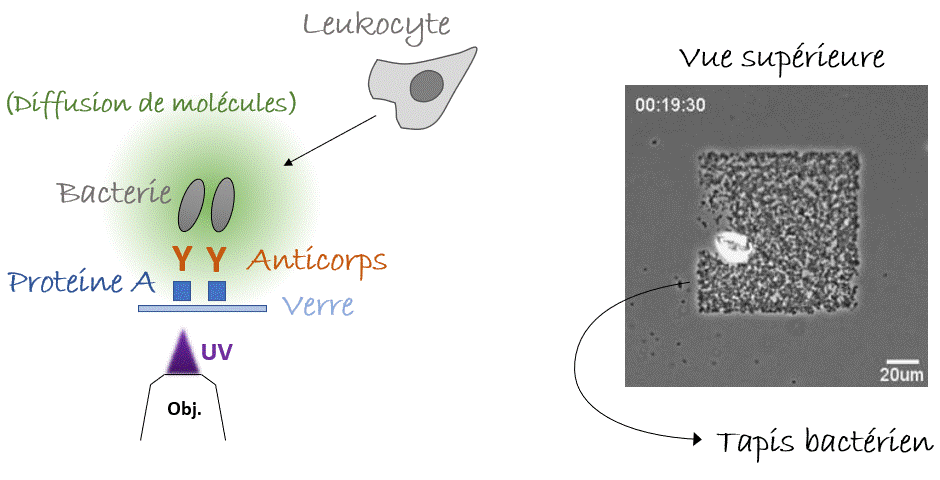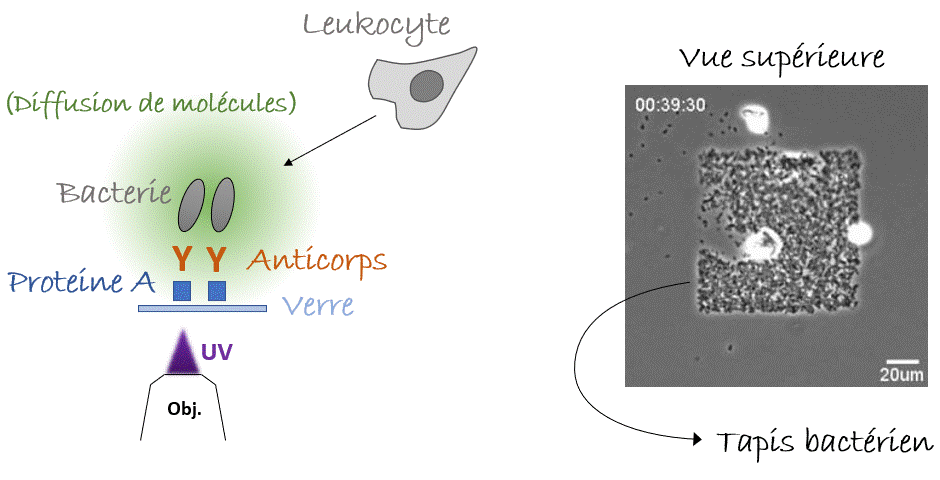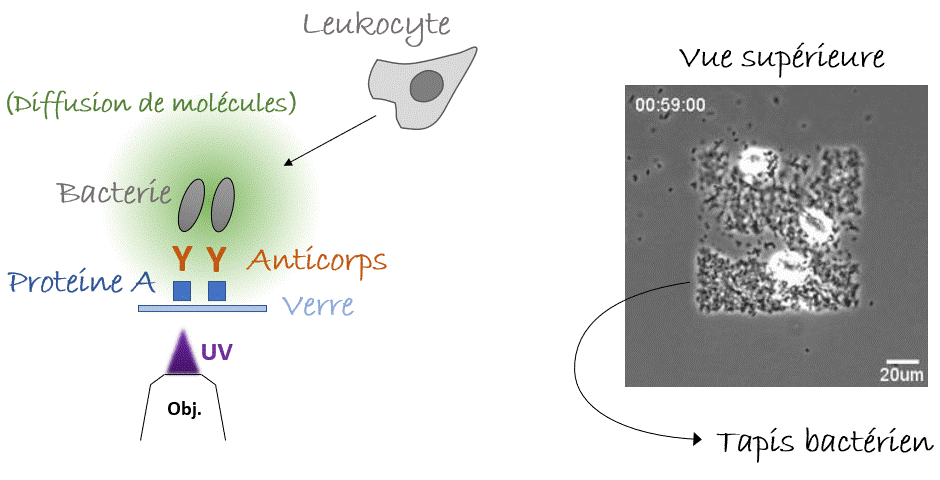
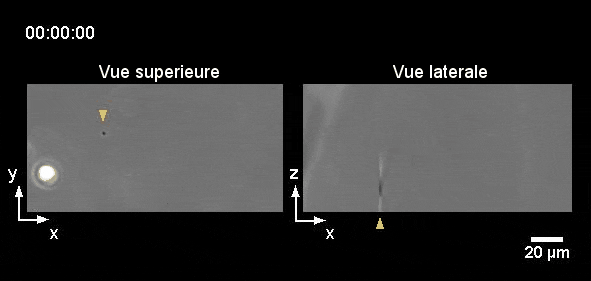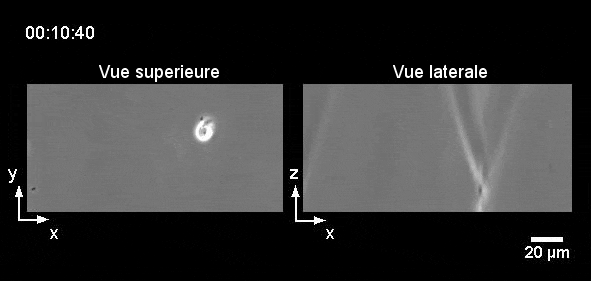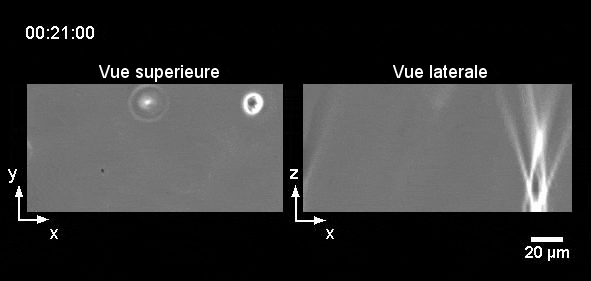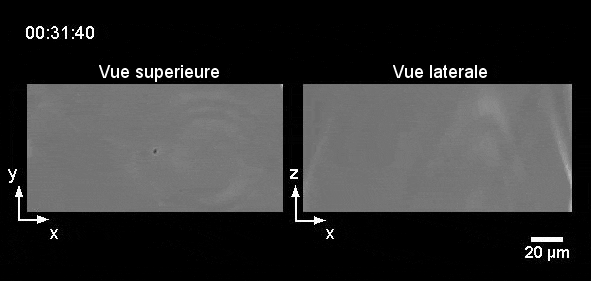
Comment tout cela fonctionnerait-il dans la vie réelle ? Eh bien, la nage des leucocytes reste toujours lente ce qui les rend très sensibles aux écoulements, et il est difficile d’imaginer un endroit du corps où il n’y a absolument aucun écoulement car cela s’avère difficile à établir même dans des conditions de laboratoire. Cependant, nous pouvons imaginer une situation où les leucocytes et les bactéries dérivent côte à côte, et où les leucocytes « tendent la main » pour attraper les bactéries « à la volée ». Sans surprise, nous avons réussi à enregistrer un tel exemple (pourtant in vitro) dans notre laboratoire (Figure 6). Alors la prochaine fois que vous vous baignerez en mer, vous pourrez penser que, peut-être, quelque part dans votre corps, vos leucocytes font eux-aussi un « plouf ».
Références
- 1 L. Aoun, A. Farutin, N. Garcia-Seyda, P. Nègre, M.S. Rizvi, S. Tlili, S. Song, X. Luo, M. Biarnes-Pelicot, R. Galland, J.-B. Sibarita, A. Michelot, C. Hivroz, S. Rafai, M.-P. Valignat, C. Misbah, and O. Theodoly, “Amoeboid Swimming Is Propelled by Molecular Paddling in Lymphocytes,” Biophysical Journal, 1157–1177 (2020).
- 2 E.M. Purcell, “Life at low Reynolds number,” American Journal of Physics, 3–11 (1977).
- 3 N. Garcia‐Seyda, V. Seveau, F. Manca, M. Biarnes‐Pelicot, M. Valignat, M. Bajénoff, and O. Theodoly, “Human neutrophils swim and phagocytise bacteria,” Biol. Cell, 28–38 (2020).






