Le milieu interstellaire, c’est-à-dire l’espace que l’on trouve en dehors des étoiles et de leurs systèmes planétaires est vide… ou presque. On y trouve quand même de la matière, même si la densité de particules y dépasse rarement celle des vides les plus poussés que l’on puisse atteindre en laboratoire sur Terre. En quantité non négligeable, en fait : lorsque l’on multiplie ces faibles densités de matière par l’espace immense que l’on trouve entre les étoiles de notre galaxie, on se rend compte que le milieu interstellaire représente 10% de sa masse totale.
Sous quelle forme est cette matière? Selon les régions observées, on la trouvera sous forme ionisée ou neutre, atomique, ou moléculaire. Ce sont dans les régions les plus froides et les plus denses que l’on trouve l’essentiel des moléculesa. Ces régions froides et denses, les nuages moléculaires, sont particulièrement intéressantes à étudier, car c’est à l’intérieur que se forment les étoiles, puis les planètes qui entoureront ces étoiles. Étudier les molécules présentes dans le milieu interstellaire présente donc un premier intérêt évident, un intérêt que l’on pourrait dire « astrobiologique » : on peut se demander comment d’une étape à l’autre du cheminement qui mène d’un nuage moléculaire à un système planétaire, l’inventaire moléculaire est conservé, enrichi ou modifié. Ou encore, à quel point les molécules observées dans le milieu interstellaire constituent un prototype des molécules qui étaient présentes sur les planètes, les astéroïdes et les comètes de notre propre système solaire avant que la vie n’y apparaisse. Cette fascinante question est cependant loin d’épuiser l’intérêt de l’observation des molécules interstellaires : d’un point de vue « astrochimique », le milieu interstellaire est un véritable laboratoire de réactions chimiques se déroulant dans des conditions (de température, de densité, d’échelle de temps) si différentes de celles dont on a l’habitude sur Terre que son étude donne un point de vue radicalement différent sur notre compréhension de la chimie. D’un point de vue « astrophysique », les molécules jouent aussi un rôle important dans les processus de formation des étoiles et des planètes, et leur observation est en fait l’un des rares moyens de tirer indirectement des informations sur ce qu’il se passe réellement dans ces régions de l’espace qui nous sont inaccessibles.
Outre les atomes et molécules qui se déplacent librement (le gaz), on trouve aussi des grains de poussière, très petits (entre quelques nanomètres et un micromètre), d’une composition encore mal connue, même s’ils sont certainement constitués pour l’essentiel de silicate et de carbone, probablement sous forme amorphe (désordonnée). Ces grains de poussière jouent aussi un rôle essentiel dans la physique et la chimie du milieu interstellaire. Par exemple, à leur surface certaines molécules peuvent se former alors qu’elles ne le peuvent pas ou difficilement dans le gaz. Dans les régions froides qui nous intéressent, ces molécules formées à la surface des grains vont généralement y rester collées. De même, lorsqu’une molécule du gaz rencontre un grain, elle peut aussi y rester collée. Nos grains de poussière vont alors se couvrir d’un manteau de molécules gelées, que l’on appelle « glace ». (À noter que ce terme est un peu impropre puisque les glaces ne sont pas composées uniquement d’eau solide, mais qu’il est largement utilisé)
De quoi sont composées les glaces interstellaires?
Les quelque 200 molécules ayant été détectées dans le milieu interstellaire l’ont été essentiellement dans le gaz. La technique utilisée pour leur détection est la spectroscopie, c’est-à-dire l’analyse des fréquences composant la lumièreb, et les molécules sont identifiées par des fréquences bien spécifiques. Notamment, de nombreuses molécules ont été identifiées par des fréquences caractérisant leur rotation, dans un domaine de longueur d’onde allant du submillimétrique au centimétrique (pour rappel). Les molécules gelées dans le manteau glacé des grains de poussière, en revanche, ne peuvent pas tourner. Mais elles peuvent encore vibrer : il faut donc utiliser la spectroscopie, mais dans le domaine de l’infrarouge prochec où les fréquences caractéristiques de la vibration des molécules apparaissent. Cependant, la composition des manteaux glacés reste connue bien moins précisément que celle du gaz.
On sait néanmoins quels en sont les composants majoritaires. En tête, on trouve l’eau (H2O), mais aussi le monoxyde et le dioxyde de carbone (CO et CO2), à hauteur de 20 à 40% de la quantité d’eau chacun. On trouve ensuite, en quantité de l’ordre de 1 à 10% de la glace d’eau, de l’ammoniac (NH3), du méthane (CH4), du méthanol (CH3OH), du formaldéhyde (H2CO) ou encore de l’acide formique (HCOOH). On soupçonne la présence de certaines autres molécules, soit qu’elles soient très probablement là, possiblement en abondance, mais très difficiles à détecter (le diazote et le dioxygène, N2 et O2, notamment), soit que leur quantité soit insuffisante pour que leur détection soit possible avec les moyens actuels.
Les manteaux de glaces constituent donc un important réservoir de molécules, mais aussi un réacteur pouvant mener à une augmentation de la complexité moléculaire. Les molécules y sont gelées, mais des espèces réactives peuvent venir du gaz, ou y être créées par apport d’énergie, notamment par l’action de lumière ultraviolette ou X (provenant des étoiles, par exemple), ou bien de rayons cosmiques susceptibles de casser les molécules stables en fragments réactifs. Sur ce point, l’astrophysique de laboratoire (l’étude par des expériences de laboratoires ou des calculs théoriques de processus pertinents pour la compréhension des phénomènes astrophysiques) amène de nombreux renseignements. Les expériences menées depuis plus de 20 ans ont montré une chose de façon assez claire : le dépôt d’énergie sous diverses formes (lumière UV ou X, électrons et ions énergétiques) dans une glace contenant, sous la forme de molécules simples telles que celles citées précédemment, quelques éléments atomiques de base (carbone, hydrogène, azote, oxygène…), mène à la formation de molécules organiques très diverses, en particulier les briques élémentaires dont sont constituées les molécules importantes pour la vie sur Terre : acides aminés, sucres, liaisons peptidiques, etc. Ces éléments nous poussent à nous demander si l’apport organique du milieu interstellaire a pu jouer un rôle dans une chimie dite « prébiotique » dans les conditions de la terre primitive.
De ce constat solidement acquis (mais qui ne reste néanmoins qu’un résultat de laboratoire: seules les plus simples de ces molécules dites prébiotiques ont été détectées dans les comètes, et moins encore dans le milieu interstellaire), les enjeux scientifiques réels se sont maintenant déplacés sur des problématiques beaucoup plus incertaines, comme, par exemple, comment ces molécules prébiotiques auraient pu passer des glaces interstellaires aux comètes, puis des comètes aux planètes ? Ou encore, comment passer au stade de complexité suivant, puisqu’il y a des limites au degré de complexité auquel l’irradiation mène ?
De la glace au gaz
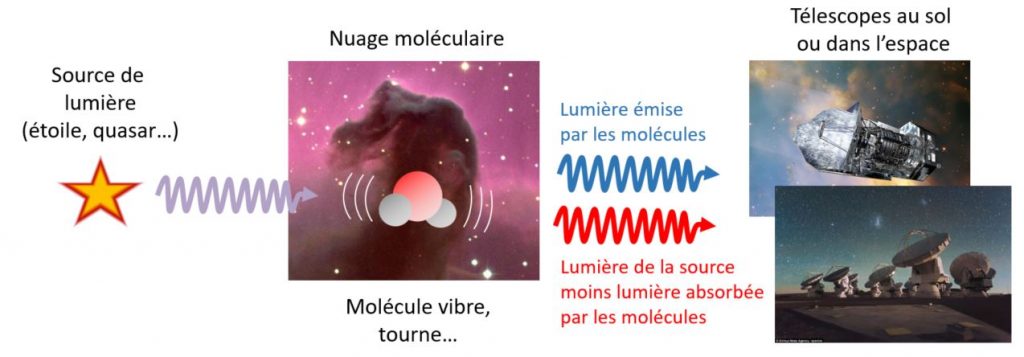
Les manteaux glacés ne se contentent pas d’évoluer en parallèle du gaz. Des interactions peuvent avoir lieu dans les deux sens : des molécules du gaz peuvent venir se coller à la surface des grains, mais les molécules gelées peuvent aussi partir dans le gaz. Aux températures très froides que nous considérons ici, cette seconde possibilité requiert cependant de l’énergie. Tout comme elle permet d’activer une chimie plus complexe, l’apport d’énergie sous diverses formes peut entraîner l’éjection de molécules des manteaux glacés. L’injection de nouvelles molécules dans le gaz par ces procédés dits « non thermiques » (car ils diffèrent d’une simple sublimation des molécules) va enrichir la chimie, bien différente de celle des grains, qui peut s’y produire. De plus, ces molécules vont pouvoir être détectées : le problème a depuis longtemps été soulevé sous différentes formes que l’observation de certaines espèces dans le gaz interstellaire ne pouvait s’expliquer que par d’une part leur formation à la surface des grains, et d’autre part leur passage des grains au gaz par un processus non thermique.
Un des processus considérés est la « photodésorption », c’est-à-dire l’éjection de molécules depuis la glace vers le gaz après absorption d’un photon. « Désorption » est un terme technique pour dire qu’une molécule se détache du solide pour aller dans le gaz. L’étude expérimentale de ce processus est l’objet de ma thèse et de l’article à l’origine de ce texte, où nous étudions le processus de photodésorption en laboratoire pour la molécule de méthane (CH4)1. Pour pouvoir comprendre les observations astrophysiques du milieu interstellaire et modéliser ces milieux correctement, il est nécessaire d’effectuer d’abord des expériences de laboratoire qui apporteront (i) des informations qualitatives permettant de modéliser le processus qui nous intéresse (de quels paramètres il dépend, comment il fonctionne du point de vue de la microphysique, etc.) (ii) du quantitatif: dans le cas présent, on veut savoir combien de molécules en moyenne seront éjectées chaque fois qu’un photon arrivera sur un manteau glacé.
Une première chose que l’on peut apprendre, par exemple, c’est comment l’énergie portée par le photon est transférée à une molécule. On a vu plus haut que chaque molécule peut émettre et/ou absorber de la lumière à des fréquences bien spécifiques, caractéristiques de leur vibration et de leur rotation. À des fréquences lumineuses plus élevées (longueur d’onde plus courte), dans l’ultraviolet, c’est encore le cas, sauf que la fréquence lumineuse absorbée correspond cette fois à l’excitation d’un électron de la molécule. De même que pour les rotations et vibrations, les fréquences correspondant à l’excitation de leurs électrons sont des signatures caractéristiques de chaque molécule.
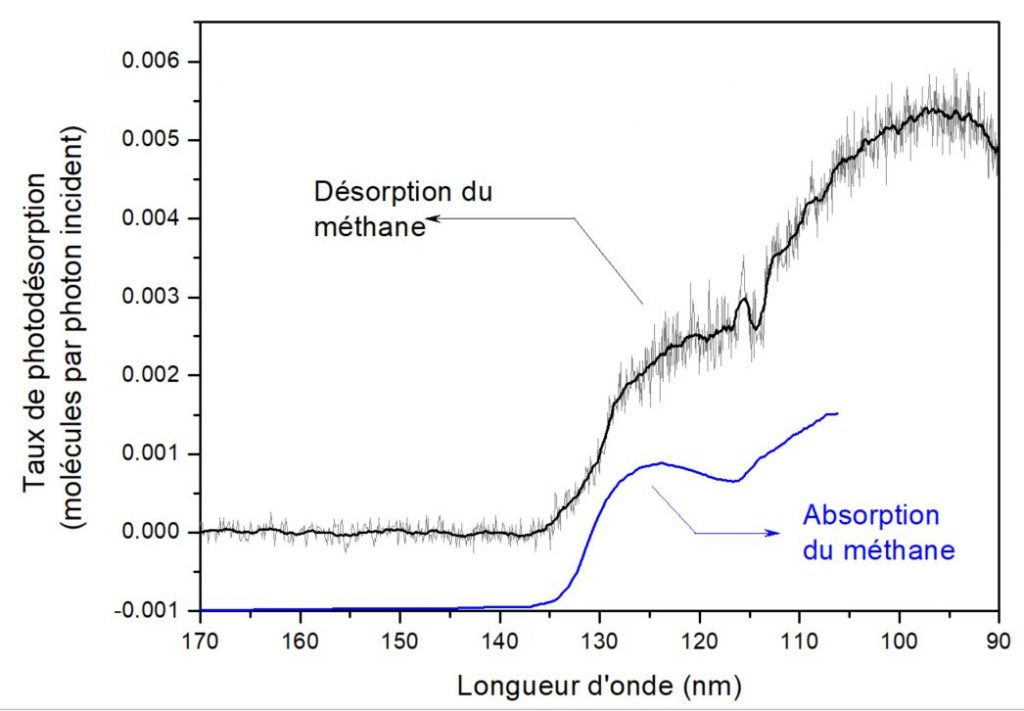
La lumière ultraviolette apporte donc de l’énergie aux molécules en excitant leurs électrons : c’est ce que l’on retrouve lorsque l’on regarde combien de molécules sont éjectées, en moyenne, de la glace, en fonction de la longueur d’onde de la lumière qu’on y envoie (fig. 2). On retrouve bien que les molécules sont éjectées proportionnellement à l’excitation électronique (c’est-à-dire l’absorption du méthane, représentée en bleu fig. 2). Les étapes suivantes, à savoir , ce l’on que fait de cette énergie « électronique » pour arriver à décoller une (ou plusieurs !) molécules, sont plus complexes à élucider.
On peut aussi s’intéresser à ce qu’il se passe lorsque l’on met en présence différentes molécules. En effet, on a vu plus haut que dans un manteau glacé, on trouve de nombreuses molécules différentes. Comment cela affecte-t-il la photodésorption ? Pour cela, on peut faire l’expérience simple suivante : on dépose une unique couche de molécules de méthane sur une glace plus épaisse de monoxyde de carbone (CO). Puis l’on effectue la même expérience que précédemment : on regarde combien de molécules de méthane sont éjectées en fonction de la longueur d’onde de la lumière UV… (fig. 3)
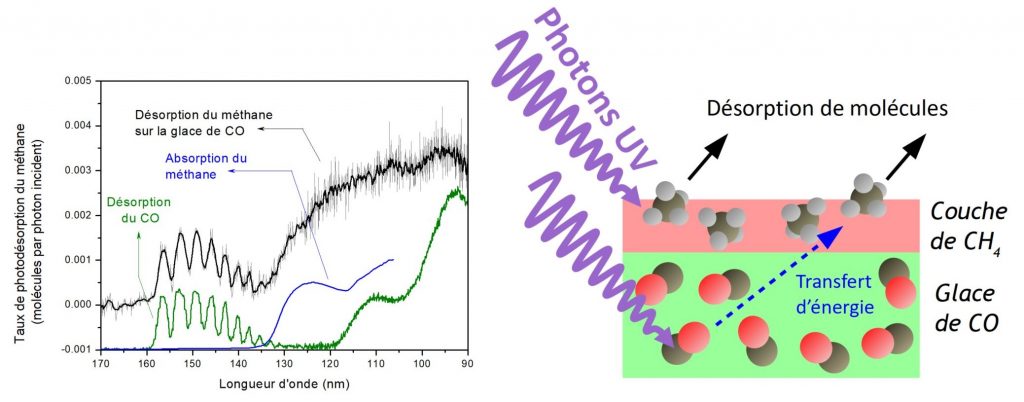
On voit alors que des molécules de méthane sont désorbées (détachées de la glace) à des longueurs d’onde auxquelles elles ne l’étaient pas auparavant : ce sont les pics que l’on voit fig. 3 entre 160 et 130 nm. Ces pics sont caractéristiques de l’excitation d’électrons non plus de la molécule de méthane, mais de celle de CO. Comme expliqué précédemment, c’est le signe qu’une molécule de CO a initialement absorbé l’énergie d’un photon. Et pourtant, c’est bien une molécule de méthane qui est détachée de la glace : c’est donc qu’un phénomène de transfert d’énergie a eu lieu. Ce n’est pas la première fois que nous observons ce type de phénomène, et ce que nous dit le cas du méthane est discuté plus en détail dans l’article.
Ce dernier exemple nous montre les subtilités qu’il peut y avoir dans l’étude de ce type de processus, qui ne peuvent se résumer seulement à un chiffre (un nombre moyen de molécules éjectées par photon, par exemple) puisque de nombreux facteurs entrent en jeu. Lorsque les facteurs se démultiplient, il est impossible d’étudier en laboratoire tous les cas possibles (toutes les combinaisons possibles de molécules, à toutes les températures, etc.), et il devient alors nécessaire de chercher les mécanismes plus fondamentaux qui gouvernent le processus afin d’en tirer des réponses plus générales, ce qui est précisément ce que nous nous employons à faire ! Par exemple, on peut pour cela essayer d’obtenir plus d’informations sur les molécules qui sont détachées de la glace dans notre expérience : par des techniques de spectroscopie, on caractérise leur vitesse, leur énergie de vibration, de rotation, etc. pour ensuite essayer d’élucider quels mécanismes correspondent à ces mesures. À ce stade, il est aussi très utile d’avoir l’appui de simulations, en collaborant avec des chimistes théoriciens. Tout ceci fait partie de nos plans futurs !
Notes
| a. | ↑ | Par « froid », on entend ici entre 10 et 100 K, c’est-à-dire entre -170 et -260 °C. Quant à la densité, elle est de l’ordre de 10 000 particules par cm3, c’est-à-dire 16 ordres de grandeur plus faible que l’atmosphère terrestre. Donc c’est quand même très vide. |
| b. | ↑ | La spectroscopie désigne ici la décomposition de la lumière en les différentes fréquences qui la composent (dans le domaine visible, par exemple, une fréquence correspond à une couleur, bien que l’inverse ne soit pas vrai). Les atomes et les molécules n’absorbent et n’émettent qu’à des fréquences leur étant propres, ce qui permet de les identifier lorsque l’on décompose la lumière nous arrivant de l’espace. Voir aussi cet article pour en savoir plus sur la spectroscopie et son utilisation comme signature des molécules. |
| c. | ↑ | L’infrarouge, comme tout le reste du spectre électromagnétique, est très utilisé en astrophysique, mais nécessite d’avoir des instruments en orbite, au contraire du millimétrique (l’atmosphère absorbant le rayonnement infrarouge). Les molécules en phase condensée sont aussi plus difficiles à détecter, car leur signature en fréquence est plus large, donc moins spécifique et plus facilement masquée. |









